Die
Anionenlücke - Übersicht
Univ.Prof.Dr.med.
Wolfgang Hübl
|
|
Info
- Referenzbereiche - Anionenlücke
bei metabolischen Azidosen - Anionenlücke bei Vergiftungen
|
|
|
| Ionen sind elektrisch geladene Atome oder Moleküle. Anionen sind
negativ geladenen Ionen, Kationen sind positiv geladene Ionen. |
|
|
| |
|
|
|
Es gibt gar keine Anionenlücke
In unserer Blutflüssigkeit ist immer ein Gleichgewicht aus negativ
geladenen Teilchen (Anionen) und positiv geladenen Teilchen (Kationen). Zu den positiv
geladenen Ionen gehört vor allem Natrium, aber auch Kalium, Kalzium, Magnesium und einige
andere. Zu den negativen Ionen gehören vor allem Chlorid- und Bicarbonationen, aber auch
Phosphat-, Sulfat-, Lactat- und viele andere Ionen.
Würde man alle Anionen und alle Kationen in der Blutflüssigkeit bestimmen, würde man
ein Gleichgewicht der Anionen- und der Kationen feststellen.
Wie kommt es dann zu einer
Anionenlücke?
Man kann nie alle Ionen der Blutflüssigkeit bestimmen. Das ist viel zu aufwändig. Man
bestimmt nur die wichtigsten Ionen: Das positiv geladene Natrium und das negativ geladene
Chlorid und Bicarbonat. Dabei fallen besonders viele negativ geladene Teilchen (also
Anionen) unter den Tisch. Vergleicht man jetzt die positiven Ionen (Natrium) mit den
negativen (Chlorid und Bicarbonat), dann überwiegen scheinbar die positiven. Die Anionen
sind zu wenig. Es besteht rechnerisch eine Anionenlücke. Aber, wie gesagt, nur weil man
nicht alle Anionen bestimmt hat.
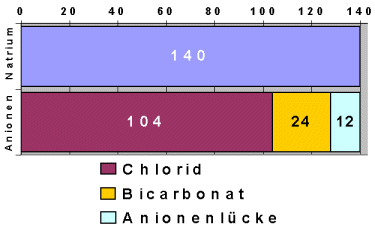 |
Graphische Darstellung der Anionenlücke
Vergleicht man das positive Natrium nur mit dem negativen Chlorid und Bicarbonat, bleibt
eine Lücke (hellblau). Die Bestimmung dieser Lücke trägt bei manchen Krankheiten zur
Diagnose bei. |
Nebenbemerkung: wenn man nur Natrium bestimmt, fehlen
natürlich auch ein paar Kationen, das fällt aber weniger ins Gewicht als die fehlenden
Anionen.
Rechen-
Beispiel: |
Ion |
Konzentration in der Blutflüssigkeit |
Ladung |
| Natrium |
140 |
+ |
| Chlorid |
104 |
- |
| Bicarbonat |
24 |
- |
Summe gemessener Kationen
(=Natrium): |
140 |
+ |
Summe Anionen: |
128 |
- |
Kationen - Anionen: |
+12 |
=Anionenlücke |
Berechnung der Anionenlücke:
Die Berechnung erfolgt also folgendermaßen:
Anionenlücke = Natrium - Chlorid - Bicarbonat (Einheiten: mmol/l). Seltener wird das
Kalium einbezogen (Natrium + Kalium - Chlorid - Bicarbonat).
Wozu ist die Berechnung der Anionenlücke gut?
Die Anionenlücke hilft,
- die Ursache einer Übersäuerung (=Azidose) des Blutes zu finden und
- sie kann bei Vergiftungen Hinweise auf die Ursache geben.
Es gibt auch negative Lücken
Sollten bei bestimmten Veränderungen einmal doch die Anionen überwiegen (Natrium kleiner
als Chlorid + Bicarbonat), spricht man nicht von einer Kationenlücke oder einem
Anionenüberschuss, wie man es erwarten könnte, sondern von einer "negativen
Anionenlücke". |
|
|
| |
|
|
|
| Berechnung |
Bereich |
Einheit |
Bereich |
Einheit |
Natrium
- Chlorid - Bicarbonat* |
8 - 16 |
mmol/l |
8 - 16 |
mval/l |
Natrium + Kalium
- Chlorid - Bicarbonat |
10 - 20 |
mmol/l |
10 - 20 |
mval/l |
*übliche
Berechnungsmethode |
|
|
| |
|
|
| |
| Hinweis: aus isolierten, leichten Erhöhungen
oder Erniedrigungen von Laborwerten kann man in den allermeisten Fällen keine
Schlussfolgerungen auf irgendeine Erkrankung ziehen. Liegen also nur leichte
Veränderungen vor, muss keineswegs irgendeine der nachfolgend genannten Erkrankungen oder
Veränderungen vorliegen! |
|
|
| ANIONEN-LÜCKE
BEI METABOLISCHEN AZIDOSEN: |
|
1. Unterscheidung
Metabolischer Azidosen
(metabolische Azidosen sind Übersäuerungen des Blutes, die nicht durch Probleme
der Atmung, also nicht durch Kohlendioxid-Überschuss bedingt sind)
|
a) Azidosen mit
vergrößerter Anionenlücke
Das passiert, wenn vermehrt (meist organische) Säuren vorhanden sind. Bicarbonat ist
vermindert, das Chlorid ist dabei nur wenig verändert.
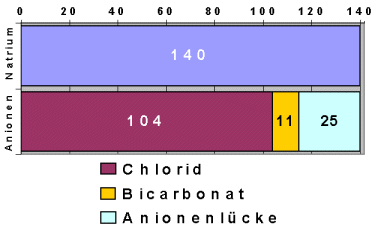 |
Azidosen mit vergrößerter Anionenlücke
Die nicht gemessenen Anionen, die bei diesen Azidosen vorkommen, verursachen die Lücke. |
- Diabetische Ketoazidose bei Zuckerkrankheit
(Insulinmangel führt zum Fettabbau - Ketonsäuren entstehen; nur bei rascher
Entwicklung entsteht eine deutliche Anionenlücke)
- Lactatazidose z.B. durch Schock
(Sauerstoffmangel im Gewebe wegen Unterdurchblutung; führt zur Vermehrung von
Lactat)
- Nierenversagen (Urämie)
(organische Säuren werden vermindert ausgeschieden, Phosphate und Sulfate
ebenfalls erhöht)
- Alkoholismus, extremes Hungern
(verminderte Nahrungsaufnahme - vermehrter Fettabbau - Ketonsäuren entstehen)
- Aspirin (=Salizylat)-Vergiftung
(auch Salizylat-Ionen sind Anionen, die nicht gemessen werden - die Anionenlücke
wird größer)
- Vergiftungen mit Methanol oder Ethylenglykol. Näheres siehe unter Vergiftungen weiter unten.
b) Azidosen mit normaler Anionenlücke
Der Abfall des Bicarbonats wird bei diesen Azidosen durch Erhöhung des Chlorids
ausgeglichen. Die Anionenlücke ist normal, das Chlorid erhöht - man nennt diese Azidosen
auch hyperchlorämische Azidosen.
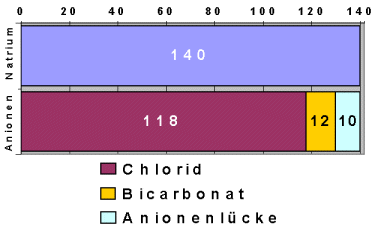 |
Hyperchlorämische Azidosen mit normaler
Anionenlücke
Die Azidose (Übersäuerung) drückt sich im Abfall des Bicarbonats aus. Die Anionenlücke
ist aber nicht vergrößert sondern die Chloridkonzentration ist als Ausgleich erhöht. |
- Durchfälle
(Bicarbonat geht im Stuhl verloren)
- Renal tubuläre Azidosen
(Ursache sind Erkrankungen der kleinen Nierenröhrchen. Bicarbonat geht im Harn
verloren [Typ II] oder Säureauscheidungsstörung [= H-Ionen-Ausscheidungsstörung;
Typ I und IV])
- Einnahme oder Gabe von Ammoniumchlorid, Lysinchlorid oder
Agininchlorid
- Azidose bei frühem Nierenversagen
- Azidose bei Harnstau
(Abflusshindernis; z.B. "Steine"; führt auch zu einer Art renal
tubulären Azidose)
- Harn gelangt durch abnorme Verbindungen in den Dickdarm
(Aus dem chloridreichen Harn wird Chlorid über den Darm aufgenommen.)
- Einnahme von Carboanhydrase-Hemmern
(Epilepsiebehandlung, Glaukom/Grüner Star-Behandlung; früher auch als
harntreibendes Mittel eingesetzt; führen zur Ausscheidung von Kaliumbicarbonat im Harn)
|
Zur weiteren Unterscheidung dieser hyperchlorämischen
Azidosen kann das Kalium helfen:
(nach Thomas, Labor und Diagnose, 5.Auflage, TH-Books)
Hyperchlorämische
Azidosen mit |
| erhöhtem Kalium |
erniedrigtem Kalium |
| Azidose bei frühem Nierenversagen |
Durchfall |
| Azidose bei Harnstau |
Carboanhydrase-Behandlung |
| Renal tubuläre Azidose Typ IV |
Renal tubuläre Azidose Typ I und II |
| Einnahme von Ammoniumchlorid, Lysinchlorid oder
Argininchlorid |
Azidosen, die sich nach einer respiratorischen Alkalose
entwickeln |
| |
Verbindungen vom Harnsystem zum Dickdarm |
|
|
|
| |
|
|
| ANIONEN-LÜCKE
BEI VERGIFTUNGEN: |
|
Vergiftungen
mit Azidose und vergrößerter Anionenlücke
- Ethylenglykol, Methanol, alkoholische Ketoazidose, Isopropanol,
Azeton, Valproinsäure, Formaldehyd, Paraldehyd, Salizylate, Sulfate, Toluol. Lactat im
Blut ist in diesen Fällen vorerst nicht erhöht.
- Eine Azidose mit vergrößerter Anionenlücke kann auch bei jeder
Vergiftung mit Leberversagen, Nierenversagen, Lungenversagen, Krampfanfällen oder Schock
auftreten. In diesen Fällen ist das Lactat im Blut aber erhöht.
|
Vergiftungen mit Azidose und
normaler Anionenlücke
- Ethanol, Propylenglykol, ev. Toluol
|
Vergiftungen mit verringerter
(teils sogar negativer) Anionenlücke
- Bromid, Iodid, Nitrat, Calcium, Magnesium, Lithium
|
|
|
| |
|
|



