Achtung!
Das ist also der erste "Fall", ein wenig auffälliger Patient. Er soll Sie an die Darstellung gewöhnen. E-mailen Sie mir, wenn die niedrige Auflösung allzu sehr stört. Ich hoffe, Sie können die Achsenbeschriftungen erahnen. Viel Spaß!
|
||
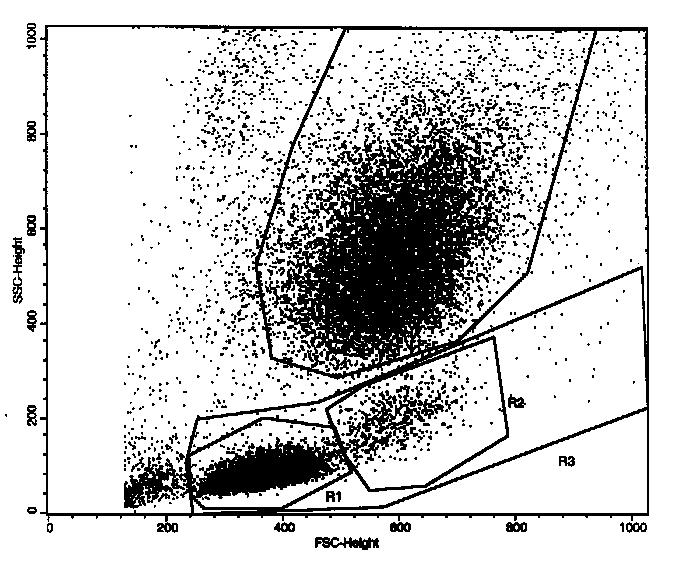 In R1 ("Lymphoregion") waren 40% aller Events, in R2 ("Monoregion") 3%, in R3 (MNC-Region) 43%, in R4 ("Neutrophilenenregion") 48%.
|
||
B-Zell-Plots |
||
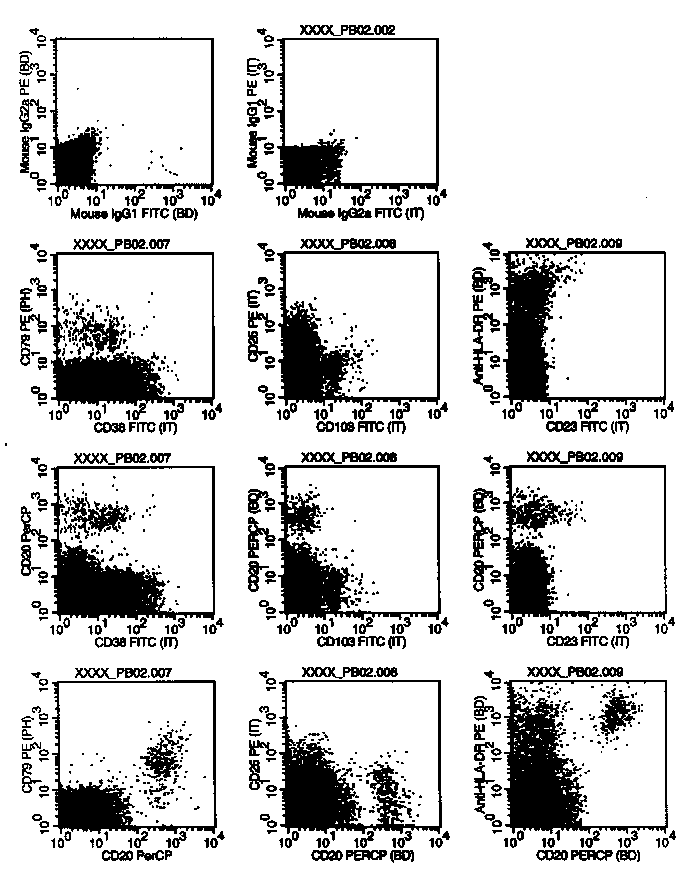
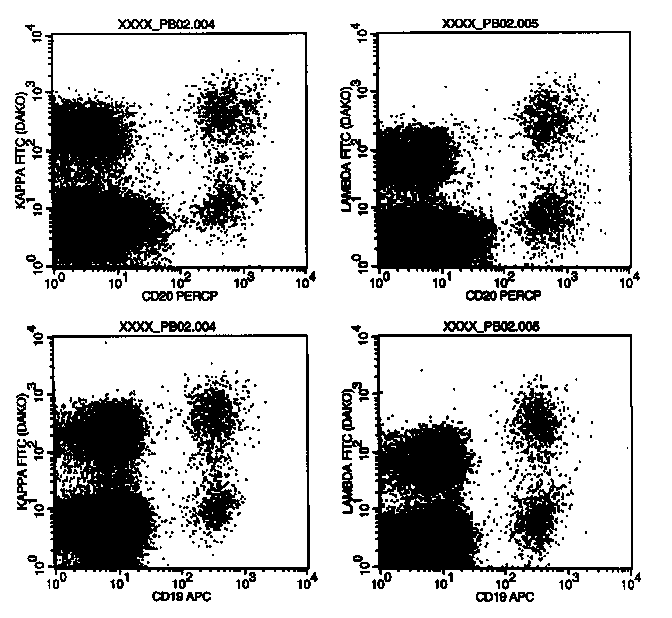 In diese Plots wurden die Zellen des Gates G3(=R3=MNC-Region) gegatet. Mit CD20 bzw. CD19 wurden die B-Zellen gegen die Leichtketten dargestellt. Man sieht in allen Plots die zwei B-Zellpopulationen, also jeweils die für die Leichtkette positive und die negative. Die CD19/20 negativen, aber Leichtkette-positiven Population sind Monozyten, die ja erstens unspezifisch Serum-Ig an der Oberfläche binden und anderseits auch den Anti-kappa bzw. Anti-lambda-Antikörper unspezifisch binden können. Die unspezifische Anfärbung der Monozyten und der für die jeweilige Leichtkette negativen B-Zellen erscheint bei kappa höher als bei lambda. Das könnte durch eine höhere Serumkonzentration der kappa-Immunoglobuline bedingt sein, die dann auch eine höhere Anlagerung an die Zellen und somit letztlich eine höhere unspezifische Anfärbung der Zellen zur Folge hat. Wie markieren ja bei der Leichtkettenmarkierung nicht nur die membranständigen, "angewachsenen" Leichtketten sondern auch die, die sich an die Zellen nur angelagert haben. Auch dreimaliges Waschen entfernt die letzteren leider nicht zur Gänze.
|
||
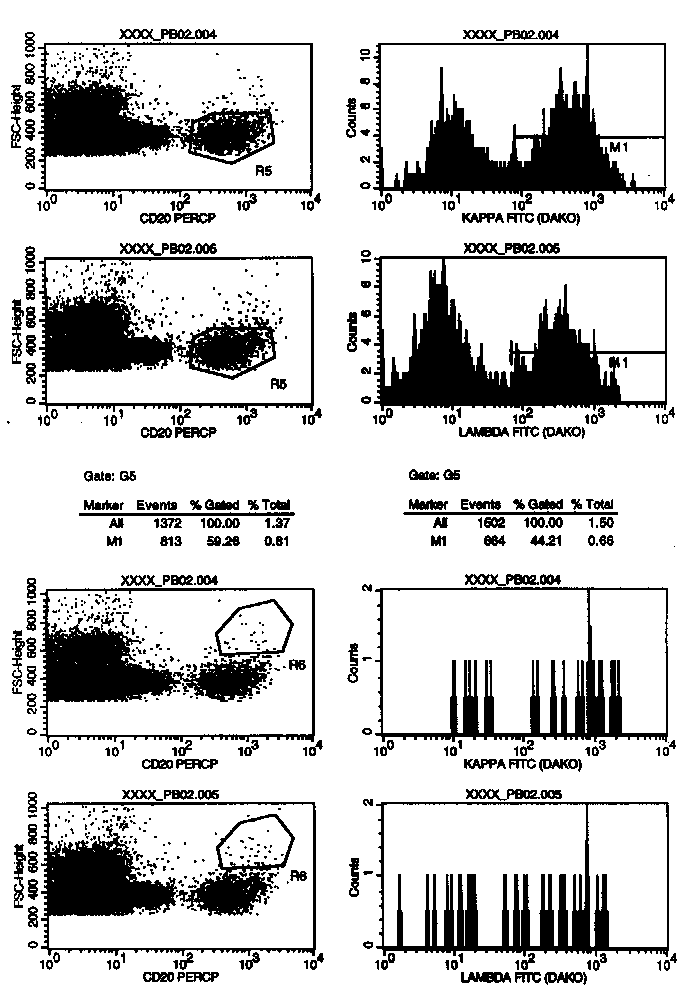 In diese Plots wurden die Zellen des Gates G3 (=R3=MNC-Region) gegatet. Die Darstellung CD20 gegen Forward Scatter erlaubt B-Zellsubpopulationen abzugrenzen, die sich durch die CD20-Expression oder/und die Größe unterscheiden. Und von diesen Subpopulation sieht man sich in den nebenstehenden kappa/lambda-Histogrammen die Klonalität an. Während der Auswertung am Bildschirm kann man die Regionen R5 und R6 auf jeden B-Zellcluster (=Haufen) legen, der einem verdächtig erscheint. Vor dem Ausdruck entscheidet man sich dann für die zwei interessantesten. Auf diese Weise erkennt man oft monoklonale Populationen, die nur einen kleinen Teil der Gesamt-B-Zellpopulation ausmachen und daher bei gleichzeitiger Auswertung aller B-Zellen nicht auffallen.
|
||
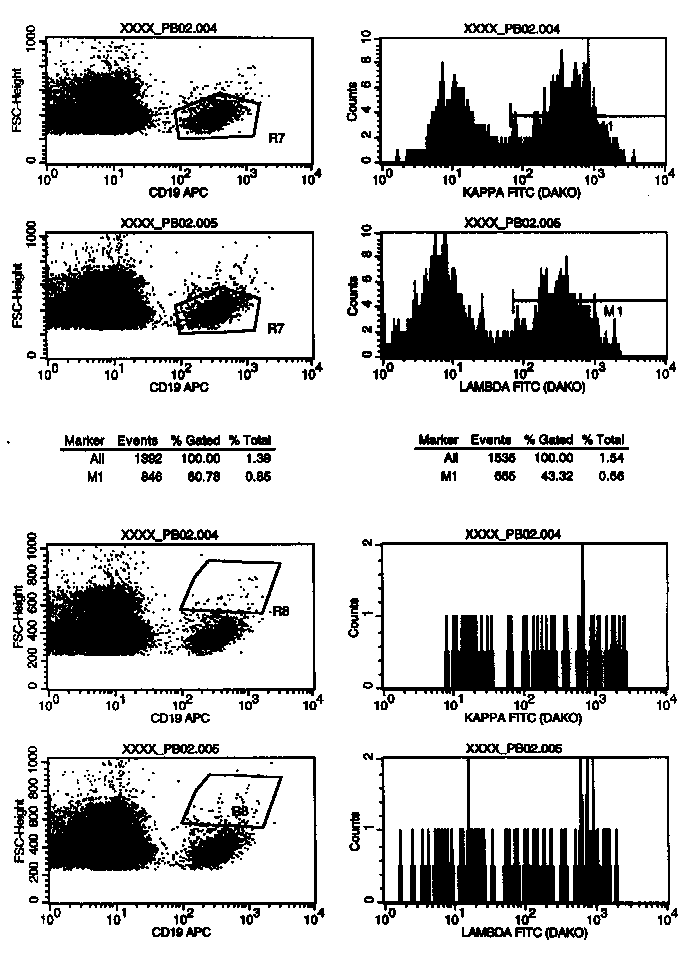 In diese Plots wurden die Zellen des Gates G3 (=R3=MNC-Region) gegatet. Die Darstellung CD19 gegen Forward Scatter erlaubt B-Zellsubpopulationen abzugrenzen, die sich durch die CD19-Expression oder/und die Größe unterscheiden. Und von diesen Subpopulation sieht man sich in den nebenstehenden kappa/lambda-Histogrammen die Klonalität an. Während der Auswertung am Bildschirm kann man die Regionen R7 und R8 auf jeden B-Zellcluster (=Haufen) legen, der einem verdächtig erscheint. Vor dem Ausdruck entscheidet man sich dann für die zwei interessantesten. Auf diese Weise erkennt man oft monoklonale Populationen, die nur einen kleinen Teil der Gesamt-B-Zellpopulation ausmachen und daher bei gleichzeitiger Auswertung aller B-Zellen nicht auffallen.
|
||
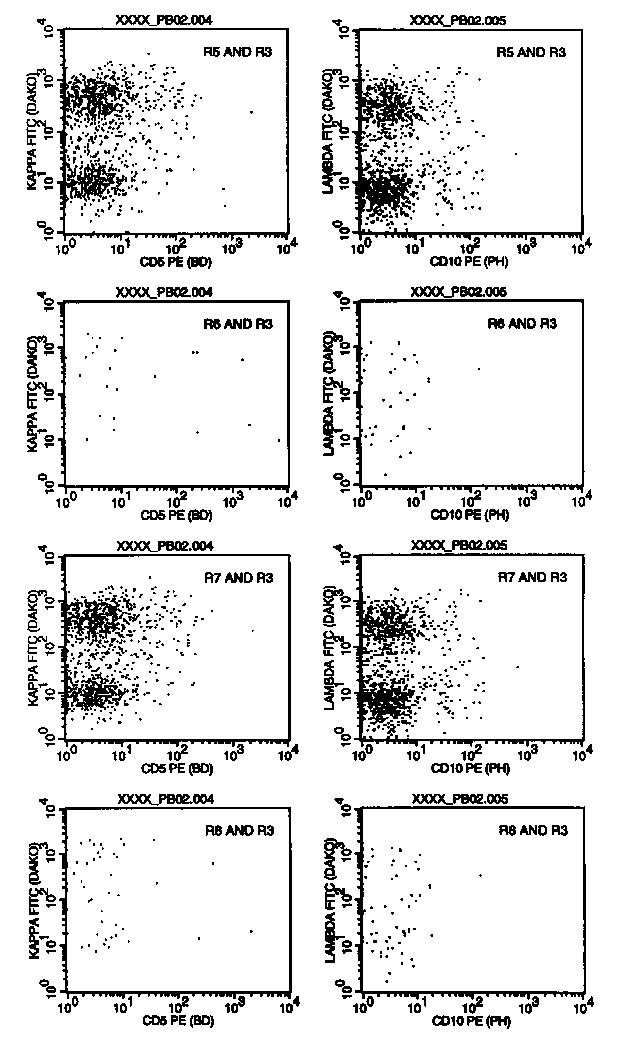 Da
wir kappa/lambda mit 3-Farben kombinieren, können wir natürlich noch mit anderen Mitteln
nach versteckten monoklonalen B-Zellpopulationen suchen: in diesen Plots sind die
Leichtketten gegen CD5 und CD10 dargestellt. Zusätzlich wurden in diese Plots nur die
Zellen aus R5, R6, R7 oder R8 gegatet. D.h. z.B.: in der obersten Dotplot-Reihe sieht man
sich die kleinen, CD20-positiven Zellen an (denn die liegen in Region 5), in der zweiten
Reihe die großen CD20-positiven Zellen (denn die liegen in Region 6). In der dritten
Reihe sind die kleinen CD19-positiven Zellen dargestellt, in der untersten die großen
CD19-positiven.
|
||
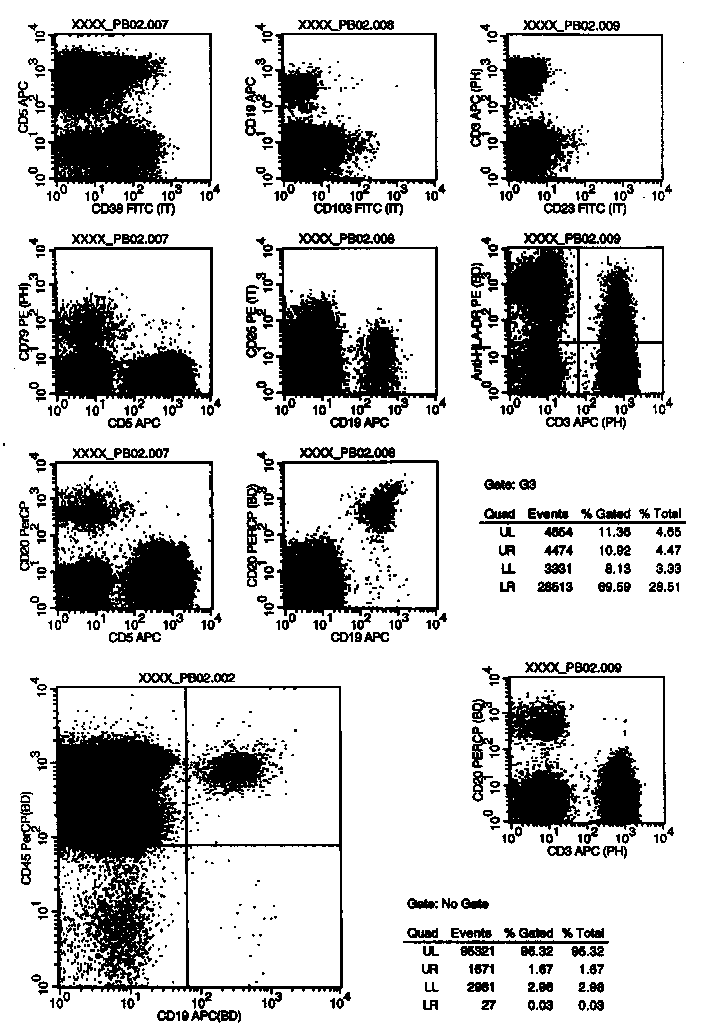
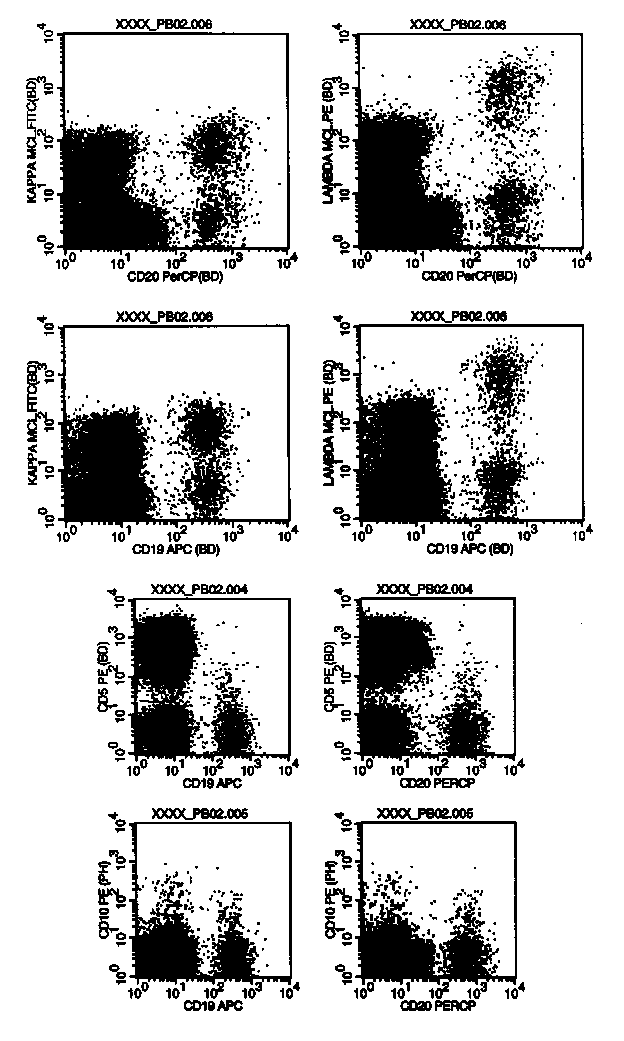 In diese Plots wurden die Zellen des Gates G3 (=R3=MNC-Region) gegatet. Im oberen Bereich sehen wir wieder die Darstellung der B-Zellen gegen die Leichtketten. Diesmal haben wir aber monoklonale Leichtkettenantikörper verwendet. Außerdem haben wir kappa und lambda in einem Röhrchen in FITC bzw.in PE konjugiert eingesetzt. Man sieht sofort den Nachteil: die kappa-Expression scheint viel schwächer als die lambda-Expression. Im unteren Teil wird die Expression der Antigene CD10 und CD5 auf B-Zellen untersucht. Wie Sie sehen, gibt es CD5+ aber auch CD10+ B-Zellen. Wir finden dies nicht so selten (bes. CD5+ können einen großen Anteil der B-Zellen ausmachen) ohne dass bei diesen Patienten ein B-NHL vorliegt. Auf der vorigen Abbildung (oberste Reihe, CD10 gegen die lambda) sehen Sie übrigens sehr gut, dass diese CD10+ B-Zellen polyklonal sind.
|
||
 Weiter
geht die Jagd nach monoklonalen B-Zellpopulation. Diesmal unter gleichzeitiger Verwendung
von kappa(FITC) und lambda(PE). Auf der linken Seite oben die kappa/lambda-Darstellung aller MNC, darunter die kappa/lambda Darstellung der Population der CD20+/CD19- Zellen, dann folgt die Population der CD20-/CD19+ Zellen. Im linken untersten Dotplot sind diese Populationen definiert.
|
||
 |
||
 Auch in diese Diagramme sind wieder die Zellen aus der Scatter-MNC Region 3 gegatet. Hier werden verschiedene Antigene gegen CD20 dargestellt. Ein Plot dient der Quantifizierung der aktivierten T-Zellen. Auf dem untersten linken Plot liegt kein Gate. Sie finden dort den Anteil der CD19+ Zellen im UR-Quadranten. |
||
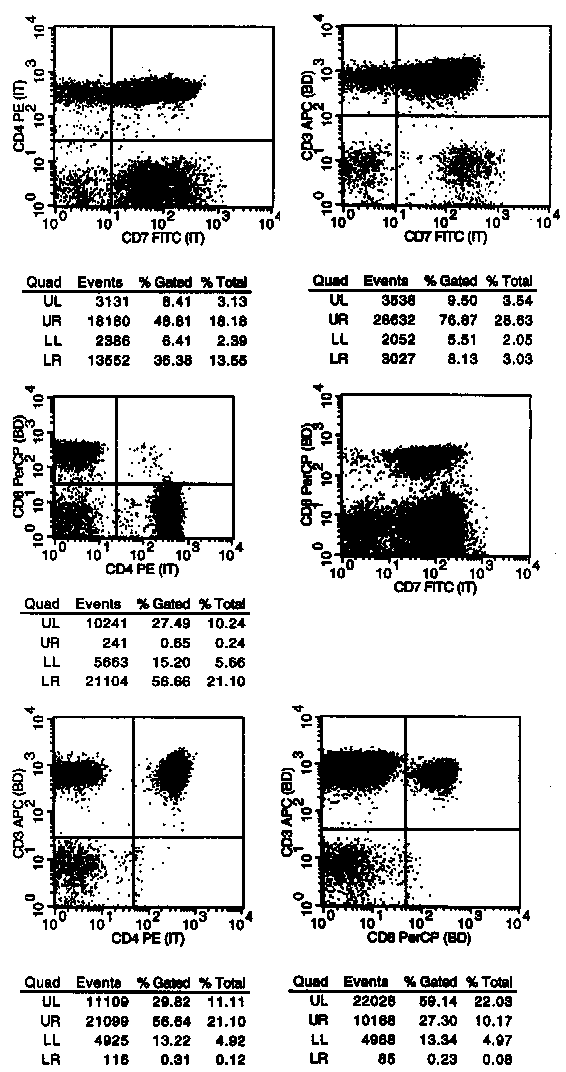
T/NK-Zell-Plots |
||
In die T/NK-Zelldotplots sind nur die Lymphozyten gegatet, dadurch lassen sich die Prozentsätze mit Ergebnissen der Lymphozytensubpopulationsuntersuchungen (Immunstaten) vergleichen. Man muss aber dann in ungegateten Plots noch darauf achten, dass man keine großen T-Zellen übersieht. Wir machen das in Marker vs. Forward Scatter Plots, die wir von allen Markern darstellen (aber aus Platzgründen nicht im Netz zeigen). In den in der obersten Reihe dargestellten CD7/CD4 bzw. CD7/CD3 Plots wird auf die CD4positiven (bzw. CD3positiven) und gleichzeitig CD7negativen T-Zellen geachtet. Einen CD7 Verlust bei T-Zellen gibt es ja bei manchen T-Zelllymphomen/Leukämien, z.B. beim Sezary-Syndrom. Die Sache kennzeichnen aber 2 Probleme: 1. Nicht alle Sezary-Syndrome sind CD7 negativ, 2. Was viel häufiger stört: auch Patienten ohne T-Zelllymphom können einen deutlichen Anteil CD7negativer T-Zellen haben. Der dargestellte Fall hat fast 10% CD7 negativer T-Zellen, auch 20-30 Prozent findet man nicht selten, im Internet wurde auch von 50% berichtet. Auch die CD7-Negativität der T-Zellen bleibt damit nur ein Mosaikstein in der Diagnose.
In der mittleren Reihe wird in der CD4/CD8 Darstellung
insbesondere auf doppelt positive Zellen geachtet. Aber auch hier gilt: viele "Gesunde"
haben einen nennenswerten Anteil von 5, 10 oder auch 20%. Eine absolute Schwelle, die für
eine monoklonale Vermehrung spricht, ist nicht definierbar. (Hinweis: finden Sie beim
Immunstatus viele 4/8-doppelt positive, dann waschen Sie das Vollblut und wiederholen
Aufbereitung und Analyse. Oft sind die Doppelt-positiven dann verschwunden. Vorheriges
Waschen hilft auch bei unerklärlichen Positivitäten des PE-Markers oft). |
||
Jetzt werden noch die
übrigen T-Zellmarker untersucht. Auch hier kann man versuchen einen CD2, CD3, oder
CD5-Verlust der T-Zellen nachzuweisen. In der obersten Reihe sind es im linken Dot-Plot im linken oberen Quadranten die CD2negativen CD3positiven T-Zellen. In diesem Quadranten findet man normalerweise nur sehr wenige Zellen. Im rechten Plot sieht man meist wenige Zellen in den Quadranten UL und LR. Im UL kann man aber manchmal CD3negative, CD5positive Zellen finden. Gerüchteweise können das aktivierte NK-Zellen sein. Tatsächlich finden wir bei hohen NK-Zellzahlen manchmal höhere Anteile in UL (und natürlich bei CD5+ CLL). Im LR (CD5-CD3+) kann man auch öfter bis zu 5 oder 10% T-Zellen finden.
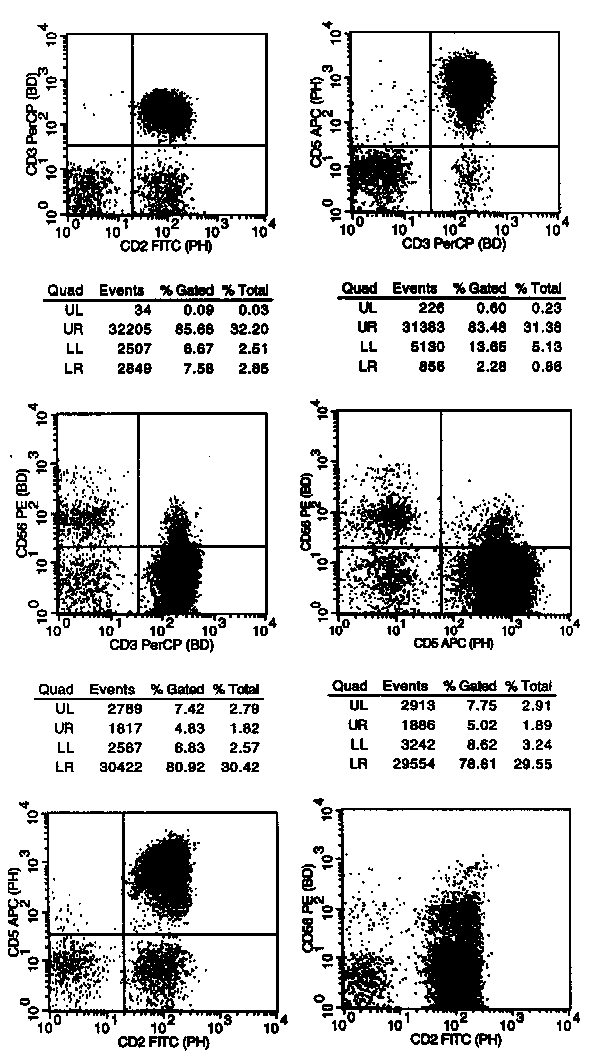
In der mittleren Reihe werden die NK-Zellen erfasst. Wie lange bekannt, teilen sie sich in eine kleinere CD56 stärkere und eine größere CD56 schwächere Population. Natürlich erfasst man mit CD56 nicht alle NK Zellen, aber man kann sich durch die interne Kontrolle T-Zellen + NK-Zellen + B-Zellen (sollte an 90-100% der Zellen im Lympho-Scattergate herankommen) ein Bild machen, ob man ungefähr richtig liegt oder ob man eine größere Zellpopulation übersehen hat. Dass man 100% mit CD56 als NK-Marker nicht erreichen wird, ist nicht weiter schlimm. Dieses Panel ist nicht primär zur Quantifizierung der Lymphozytensubgruppen sondern zur Erkennung von Lymphomen gedacht. |
||
Unreife Zellen |
||
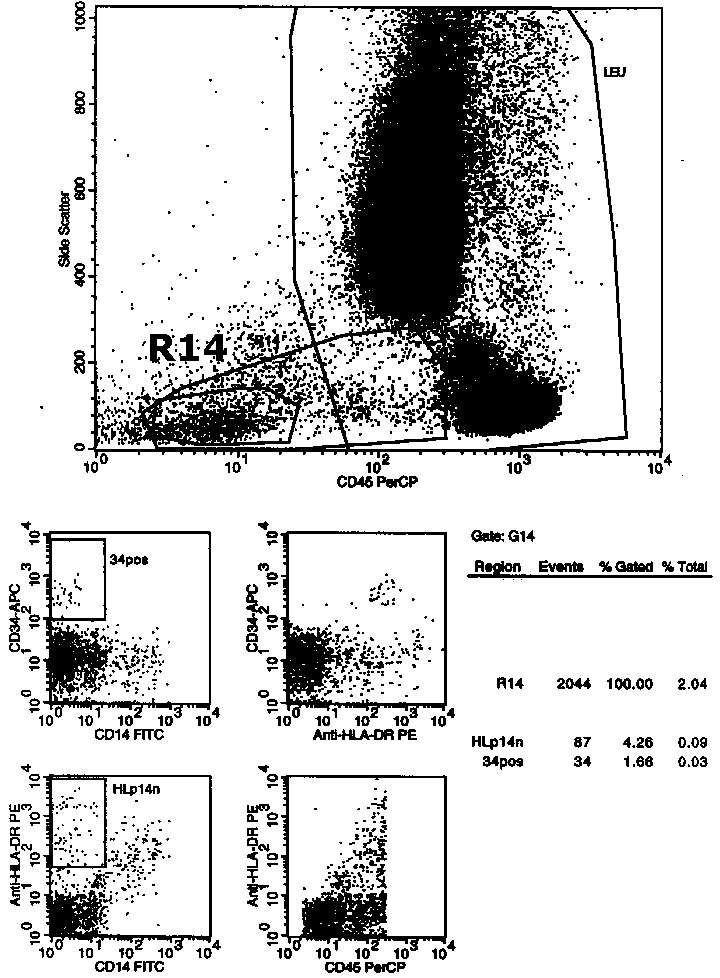 Obwohl mit dem Panel in erster Linie reifere Lymphome gesucht werden, suchen wir auch nach unreifen Zellen, wobei die Darstellung CD45 gegen Side Scatter am hilfreichsten ist. Abnorme unreife Zellen findet man meist in der als R14 bezeichneten Region. Leider findet man dort auch normale unreife Vorstufen, Plasmazellen (CD38+++) und Basophile (HLA-DR negativ). Auf den CD34er darf man sich bei der Suche nach unreifen Zellen/Blasten nie verlassen, er ist oft negativ! |
||
NRBC, Plasmazellen |
||
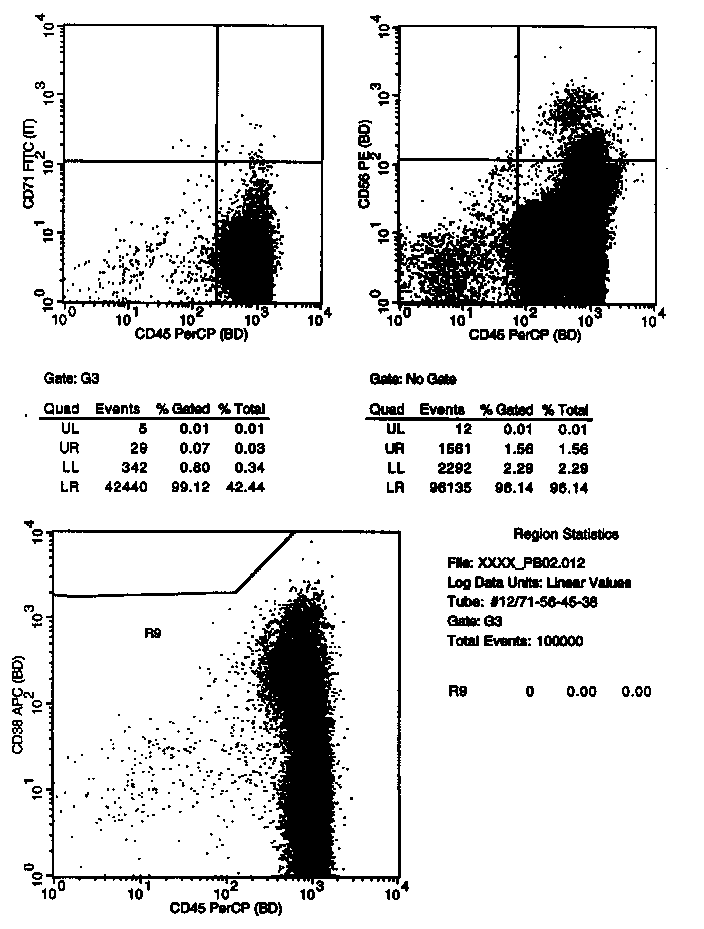 Um das Bild der Zellen in der Probe zu vervollständigen, sind mittels CD71 auch die roten Vorstufen markiert und durch die Darstellung CD45 gegen CD38 die Plasmazellen. Die auffällige, abgesetzte Population im CD45/CD56 Plot sind die CD56 starken NK-Zellen (diese Population erscheint in diesem Plot größer als in den T/NK-Zellplots. Das liegt daran, dass in den letzteren der Übersichtlichkeit wegen nicht 100% der gemessenen der Zellen dargestellt wurden). |
||