|
Zusammenfassung Die Durchflusszytometrie ist ein
unverzichtbarer Bestandteil der Diagnostik und Verlaufsbeobachtung von Leukämien und
Lymphomen. Wenn die Anwendung auf diesem Gebiet auch sehr komplex sein kann und viel
Erfahrung erfordert, beruht sie doch auf relativ einfachen Prinzipien. Diese Prinzipien
sollen auf dieser Seite mit Hilfe von zahlreichen Beispielen dargesetllt werden. |
|
|
|
|
|
|
|
|
|
|
|
I. Was
erwartet der zuweisende Arzt von der durchflusszytometrischen Untersuchung? Es gibt natürlich sehr viele verschiedenen Fragestellungen, derentwegen eine
Probe bei Leukämie oder Leukämieverdacht zur durchflusszytometrischen Analyse eingesandt
wird. Prinzipiell lassen sich die meisten Fragestellungen aber auf einige wenige
zurückführen.
- Was ist das?
Der zuweisende Arzt sieht etwas, braucht aber eine nähere Abklärung?
- Z.B. bei einem Patienten mit starker Vermehrung der Lymphozyten im Blut, man weiß aber nicht sicher, ob das
Ausdruck einer Leukämie ist oder vielleicht nur eine reaktive Veränderung
(Virusinfektion, z.B. Morbus Pfeiffer). Die durchflusszytometrische Analyse kann dies gut
unterscheiden
- Man hat im Mikroskop eindeutig Blasten festgestellt, es liegt eine
akute Leukämie vor. Aber welche? Denn es macht einen Unterschied, ob eine lymphatische
oder eine myeloische akute Leukämie vorliegt. Sowohl für die Therapie als auch für die
Prognose der Erkrankung. Im Mikroskop ist diese Frage nicht immer leicht zu beantworten,
die durchflusszytometrische Untersuchung kann dies fast immer klären.
- Manchmal hilft die Durchflusszytometrie auch bei der Erkennung der
Untergruppe einer Leukämie, hilft also z.B., unter den akuten myeloischen Leukämien eine
sog "M7", eine Megakaryoblastenleukämie zu erkennen.
Oder sie hilft, bei einer chronischen Leukämie der Lymphozyten eine typische CLL oder
Haarzell-Leukämie oder andere Untergruppen zu unterscheiden.
- Ist da etwas?
Der zuweisende Arzt sieht nichts Bestimmtes, der Patient hat aber Beschwerden oder
Symptome, die durch eine Leukämie oder ein Lymphom verursacht sein könnten.
Das ist eine aufwändige und leider oft undankbare Aufgabe für den Laborarzt. Manchmal
gleicht es der Suche nach der Nadel im Heuhaufen. Und man sucht vielleicht sogar im
falschen Heuhaufen, weil Blut zur Untersuchung eingeschickt wird, sich ein Lymphom aber
oft nur im Knochenmark oder gar nur in den Lymphknoten zeigt. Der zuweisende Arzt muss
sich also bewusst sein, dass auch bei unauffälligem durchflusszytometrischen Befund eine
hämatologische Erkrankung vorliegen kann. Ebenso wichtig ist, dass der zuweisende Arzt
weiß, welche Erkrankungen man durchflusszytometrisch überhaupt nicht nachweisen kann
(z.B. den Morbus Hodgkin).
Kurz: wenn man bei der durchflusszytometrischen Analyse nichts findet, ist das keineswegs
ein Beweis, dass keine Leukämie oder kein Lymphom vorliegt.
- Ist da noch etwas?
Die Verlaufskontrolle von Leukämien und Lymphomen: Man muss kontrollieren, ob noch
Leukämie-/Lymphomzellen vorhanden sind.
Das funktioniert sehr gut, wenn sich die kranken von den normalen Zellen stark
unterscheiden. Dann kann man schon kleinste Mengen noch oder schon wieder vorhandener
Leukämie- oder Lymphomzellen nachweisen. Fallweise kann auch ein Anteil von nur
0.1 % noch eindeutig erkennbar sein.
Die Verlaufskontrolle kann aber auch schlecht funktionieren, wenn sich die Leukämie- oder
Lymphomzellen nur wenig von den normalen Zellen unterscheiden. Da hat man manchmal auch
bei 1-2 % dieser Zellen Zweifel, ob es jetzt normale oder kranke Zellen sind. Im
ungünstigsten Fall, z.B. bei wenig auffälligen T-Zell-Lymphomen könnte man auch noch
größere Anteile pathologischer Zellen übersehen.
|
 |
|
|
|
|
II. Wie merkt man bei der durchflusszytometrischen Analyse, dass die
Probe nicht normal ist? Wenn die Erkennung
abnormaler Zellen auch im Detail sehr komplex sein kann, gibt es doch ein paar
grundlegende Prinzipien, die im Folgenden auf einfache Weise erklärt sein sollen.
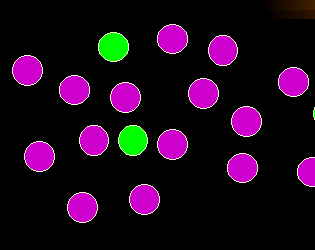 |
Der Normalbefund
Nehmen wir an, dies ist der Normalbefund. Sie sehen wenige grüne Zellen und eine
dominierende violette Zellpopulation. |
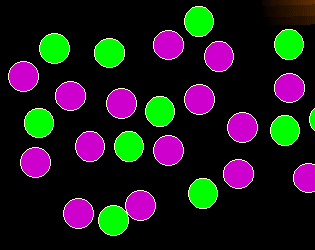 |
Was stimmt hier nicht?
Sie sehen auf den ersten Blick: zu viele grüne Zellen. Anders ausgedrückt: die quantitativen
Verhältnisse der Zellen zueinander stimmen nicht.
So einfach das ist, ist es doch ein wichtiges Merkmal für die Diagnose von Leukämien und
Lymphomen |
 |
Was stimmt hier nicht?
Zu viele grüne haben wir hier nicht. Aber dafür sind da weiße Zellen, die im
Normalbefund nicht waren. D.h., das Auftreten von normalerweise nicht vorhandenen
Zellen ist ein weiteres Merkmal, das auf eine krankhafte Veränderung hinweisen
kann.
|
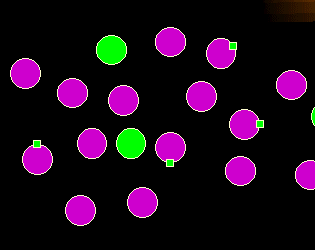 |
Was stimmt hier nicht?
Die violetten Zellen sehen anders aus. Sie haben ein abnormes "Mal" auf ihrer
Oberfläche. Die Ausprägung abnormer Merkmale (Expression abnormer Antigene)
ist wichtiger Hinweis auf pathologische Zellen.
|
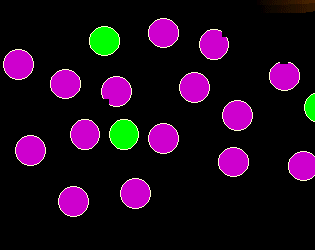 |
Was stimmt hier nicht?
Hier fehlt manchen violetten Zellen etwas. Dies soll ein weiteres, mögliches Merkmal
pathologischer Zellen symbolisieren: das Fehlen von normalerweise vorhandenen
Merkmalen (Antigenverlust).
Man kann dies auch als Variante des vorigen Punktes sehen (abnorme
Antigenexpression). |
Das war es im Wesentlichen. So viele Möglichkeiten abnorme
Zellen zu erkennen gibt es also gar nicht. Diese Prinzipien - in den verschiedensten
Variationen angewandt - helfen, pathologische Proben von normalen zu unterscheiden.
|
 |
|
|
|
|
III. Durchflusszytometrische
Untersuchungen bei Verdacht auf reife B-Zell-Lymphome / reife B-Zell-Leukämien Allgemeines
Dabei handelt es sich um maligne Proliferationen (Vermehrungen) von reifen B-Lymphozyten,
die man alle zu den B-NHL, den B-Non-Hodgkin-Lymphomen
zählt. Die Grenze zwischen Lymphomen (Erkrankung vorwiegend im Lymphknoten oder anderen
lymphatischen Organen) und Leukämien (massive Ausschwemmung der Zellen ins Blut) ist
fließend und willkürlich.
In diese Gruppe fallen die klassischen chronischen B-Zell-Leukämien, die CLL
(Chronisch Lymphatische Leukämie), die HCL (Haarzell-Leukämie) oder die
PLL (Prolymphozytenleukämie). Aber auch das IC (Immunozytom,
inkl. Morbus Waldenström), das MCL (Mantelzell-Lymphom), das FL (Follikuläres
Lymphom) und das DLC-Lymphom (Diffuses großzelliges Lymphom)
gehören zu dieser Gruppe.
Warum fangen wir mit diesen Erkrankungen an? Weil die
Durchflusszytometrie für die Diagnose und Einteilung dieser Erkrankungen eine
entscheidende Rolle spielten kann.
Abschnitte:
|
 |
|
|
|
|
Die
Stufen der Diagnose der reifen malignen B-Zellerkrankungen
- Finden der abnormen B-Zellpopulation
(Sind überhaupt pathologische, maligne B-Zellen vorhanden?)
- Definieren der
Antigenexpression der pathologischen B-Zellpopulation (Welche Merkmale tragen
die pathologischen Zellen an ihrer Oberfläche?)
- Diagnose
Manchmal sagen einem die durchflusszytometrischen Ergebnisse, welche Erkrankung, welches
B-NHL vorliegt, manchmal kann man die möglichen Erkrankungen zumindest eingrenzen.
Anmerkung: diese Stufen bedeuten nicht unbedingt auch mehrere
Untersuchungsschritte. Die Stufen sind eher als gedankliche Schritte aufzufassen, mit
denen man sich der Diagnose nähert. |
 |
|
|
|
|
1. Die Suche nach monoklonalen B-Zellen Was sind monoklonale B-Zellen?
Ein B-Zellklon ist eine Gruppe von identischen B-Zellen, die durch Teilung aus einer
einzigen Zelle hervorgegangen sind, wie das bei einer Leukämie oder einem Lymphom der
Fall ist.
Warum sucht man nach monoklonalen B-Zellen?
Das Auffinden einer monoklonalen B-Zellpopulation ist der wichtigste
(durchflusszytometrische) Befund für die Diagnose einer malignen reifen B-Zellerkrankung.
Findet man keine Monoklonalität, spricht das gegen eine solche Erkrankung (sofern man
gründlich im Blut, Knochenmark und wenn notwendig auch in Lymphknotenproben danach
gesucht hat). Findet man eine B-Zell-Monoklonalität und dazu passende Beschwerden,
Symptome oder Befunde des Patienten ist das Vorliegen einer B-Zell-Leukämie oder eines
B-Zell-Lymphoms sehr wahrscheinlich.
Gibt es auch monoklonale B-Zellpopulation ohne Leukämie
oder Lymphom?
Seit man mit empfindlichen Methoden danach suchen kann, findet man nicht so selten
zufällig monoklonale B-Zellpopulation bei Patienten, die ansonsten keinerlei Hinweise auf
eine Leukämie oder ein Lymphom aufweisen. Es wird sich dabei in vielen Fällen um
Frühstadien maligner B-Zellerkrankungen handeln. Es gibt aber noch wenig Daten darüber,
in wie vielen Fällen diese dann wirklich zum Ausbruch kommen.
Wie findet man durchflusszytometrisch monoklonale B-Zellen?
Bei manchen Zellen ist es sehr schwierig eine Monoklonalität nachzuweisen. Bei B-Zellen
ist es glücklicherweise relativ leicht, mittels Durchflusszytometrie eine monoklonale
B-Zellpopulationen nachzuweisen. Dies soll nachfolgend auf einfache Weise in mehreren
Schritten erklärt werden.
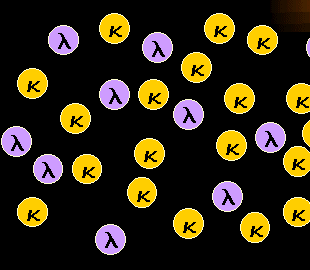
|
Normale, polyklonale B-Zellen sind ein Gemisch aus
kappa- und lambda-B-Zellen.
Unsere B-Zellen haben eine besondere Eigenschaft, die ihre Klonalität leicht beurteilen
lässt: Sie haben entweder eine kappa- oder eine lambda-Leichtkette an ihrer Oberfläche.
Und normale, polyklonale B-Zellen sind daher ein Gemisch aus kappa-B-Zellen und
lambda-B-Zellen. So wie sie es schematisch links dargestellt sehen. |
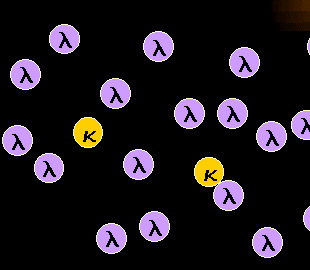
|
Monoklonale reife B-Zellen sind entweder kappa- oder
lambda-B-Zellen
Vermehrt sich ein maligner Klon auf Kosten der anderen, dann entsteht eine
B-Zellpopulation die fast nur aus kappa- oder fast nur aus lambda-B-Zellen (siehe Schema
links) besteht.
Anmerkung: In seltenen Fällen zeigen die B-Zellen weder eine kappa- noch eine
lambda-Expression - dann wird es schwieriger. |
Monoklonale B-Zellen unterschieden sich also von polyklonalen
dadurch, dass sie kein Gemisch von kappa- und lambda-B-Zellen sind, sondern dass eine
Population (kappa oder lambda) überwiegt.
Aber wie weist man das jetzt durchflusszytometrisch nach? Man färbt die Leichtkette
(kappa oder lambda) mit geeigneten fluoreszierenden Antikörpern, misst die Zellen am
Durchflusszytometer und sieht sich die Ergebnisse an:
Beurteilung der Klonalität
von B-Zellen
1. Normale, polyklonale B-Zellen |

|
Markierung der kappa-B-Zellen
Wenn wir mit einem Anti-kappa-FITC* Antikörper, also einem grün-fluoreszierenden
Antikörper färben, werden alle kappa-B-Zellen markiert.
Anmerkung: Normalerweise hat man etwas mehr kappa- als lambda-B-Zellen. Ein
leichtes Übergewicht der kappa-B-Zellen ist daher durchaus normal.
*FITC: Fluoresceinisothiocyanat. |
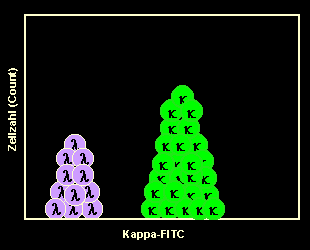
|
Messung am Durchflusszytometer
Nach der Messung am Durchflusszytometer lassen wir uns das Ergebnis z.B. in einem
sog. Ein-Parameter-Histogramm darstellen. Man sieht den größeren Haufen von
grünfluoreszierenden kappa-B-Zellen, aber auch einen 2. Haufen nicht-fluoreszierender
Zellen, das sind die unmarkierten lambda-B-Zellen. Dies ist ein typisches Bild bei
normalen, polyklonalen B-Zellen. |
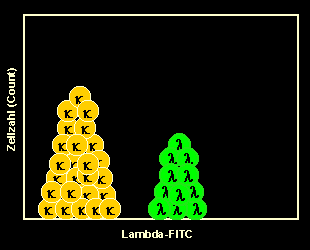
|
Man färbt natürlich auch die lambda-B-Zellen mit einem
Anti-lambda-Antikörper und erhält ein spiegelbildliches Ergebnis.
Anmerkung: Im Beispiel links wurde für lambda ebenfalls ein FITC-markierter
Antikörper verwendet, der in einem zweiten Röhrchen eingesetzt wurde. Nimmt man kappa-
und lambda-Antikörper in verschiedenen Farben, kann man beide in einem Röhrchen ansetzen
|
In diesem Beispiel war die B-Zellpopulation polyklonal, was
aus dem relativ gleichmäßigen Auftreten von kappa- und lambda-B-Zellen zu schließen
ist. Im nächsten Beispiel sehen die B-Zellen bei der Leichtkettenfärbung ganz anders
aus:
Beurteilung der
Klonalität von B-Zellen
2. Abnormale, monoklonale B-Zellen |
|
Markierung der kappa-B-Zellen
Hier werden mit der kappa-Färbung nur wenige B-Zellen gefärbt, weil die
lambda-B-Zellen überwiegen. |

|
Messung am Durchflusszytometer
Nach der Messung am Durchflusszytometer sieht das Ergebnis so aus. Wir haben kaum
einen kappa-Peak ("Haufen). Die (ungefärbten) lambda-B-Zellen dominieren. |

|
Daher dominiert in der lambda-Färbung der Haufen der
positiven Zellen. Dies spricht für das Vorliegen von monoklonalen B-Zellen, die
Leukämie- oder Lymphomzellen sein könnten. |
Soweit zur schematischen Darstellung. In der Wirklichkeit
sehen die Diagramme etwas anders aus. Nachfolgend daher reale Beispiele einer normalen,
polyklonalen und einer klonalen Leukämiepopulation.
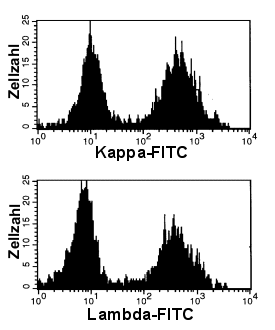 |
Normale, polyklonale B-Zellen
Die zweigipfelige, relativ gleichmäßige Verteilung der B-Zellen bei der kappa- und bei
der lambda-Färbung, lässt auf eine normale, polyklonale B-Zellpopulation schließen.
Anmerkung: eine kleine, abnorme Population würde man natürlich so nicht erkennen.
Aber dazu weiter unten mehr. |
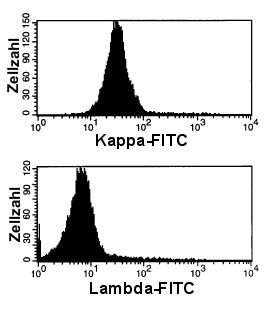 |
Abnormale, monoklonale B-Zellen
Hier zeigt sich eine eingipfelige Verteilung. Die Zellen sind kappa-positiv. Es
liegt also eine kappa-klonale B-Zellpopulation vor. Fast alle B-Zellen gehören zu dem
malignen Klon.
Es handelte sich bei diesem Fall um eine B-CLL (Chronisch Lymphatische Leukämie).
Im unteren Diagramm sind die gleichen Zellen in der Lambda-Färbung dargestellt.
Sie sind erwartungsgemäß negativ. |
In den obigen Schemata haben wir ohne es besonders
hervorzuheben immer nur die B-Zellen betrachtet, weil uns nur die B-Zellen interessiert
haben. Das ist aber nicht selbstverständlich, denn in einer Probe gibt es aber sehr viele
andere Leukozyten, nicht nur B-Zellen. Die Leichtkettenfärbung (kappa/lambda) allein
sortiert uns die B-Zellen nicht heraus, Leichtketten-Antikörper färben auch andere
Zellen.
Daher markiert man bei der Leichtkettenfärbung gleichzeitig ein B-Zellmerkmal. D.h., man
verwendet gleichzeitig einen fluoreszierenden-Antikörper gegen dieses Merkmal. Solche
B-Zellmerkmale sind z.B. CD19 oder CD20. Man markiert z.B. die Leichtkette mit einem
FITC-Antikörper (Fluoresceinisothiocyanat; grün) und das B-Zellmerkmal CD19 mit einem
PE-Antikörper (PE: Phycoerythrin; gelbrot).
Und so kann man sich die Ergebnisse dann auch als Zweifarbmarkierung darstellen, als sog.
2-Parameter-Dot-Plots:
Normale Polyklonale
B-Zellen in 2-Parameterdarstellung |
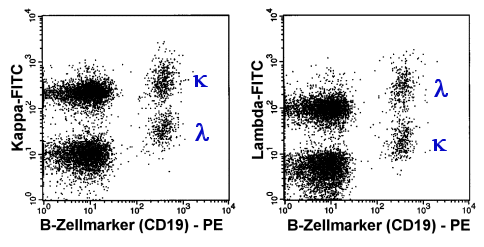 |
Die B-Zellen wurden mit mit CD19-PE markiert. Gleichzeitig
wurde im ersten Röhrchen kappa mit einem FITC-Antikörper markiert (links), im zweiten
lambda. |
Die mit griechischem k
bzw. l bezeichneten Populationen sind die
kappa- bzw. lambda-B-Zellen. Das Verhältnis ist etwa ausgeglichen. Dies lässt auf eine
polyklonale Population schließen.
Anmerkung: die CD19-negativen Populationen (jeweils in den linken
Dot-Plot-Abschnitten) sind einmal die T-Zellen ("links unten") und die Monozyten
("links oben"). Die letzteren zeigen eine starke unspezifische Bindung von
Antikörpern und werden daher in der kappa- und lambda-Färbung meist stark positiv. |
Das obige Diagramm zeigt das typische Bild der normalen
Leichtkettenexpression von normalen, polyklonalen B-Zellen. Im nächsten Diagramm sind dem
die malignen Zellen einer Chronisch Lymphatischen Leukämie gegenüber gestellt.
| Abnormale, monoklonale
B-Zellen in 2-Parameterdarstellung |
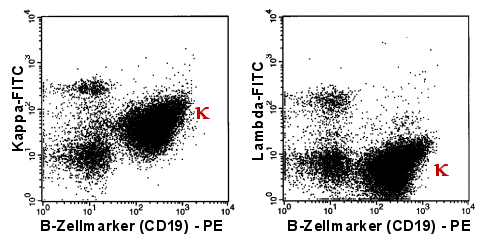 |
Die B-Zellen wurden mit mit CD19-PE markiert. Gleichzeitig
wurde im ersten Röhrchen kappa mit einem FITC-Antikörper markiert (links), im zweiten
lambda. |
| Die mit griechischem k
bezeichneten Populationen sind die kappa-B-Zellen. Das extreme Überwiegen von
kappa-B-Zellen beweist die monoklonale B-Zellpopulation. |
Die gleichzeitige Färbung von anderen Merkmalen der B-Zellen
dient aber nicht nur ihrer Identifikation. Sie kann oft auch helfen, kleinere monoklonale
B-Zellpopulationen zu finden. Dies ist im nächsten Beispiel dargestellt.
Auffinden kleinerer monoklonaler B-Zellpopulationen durch
gleichzeitige Messung mehrerer Zellmerkmale |
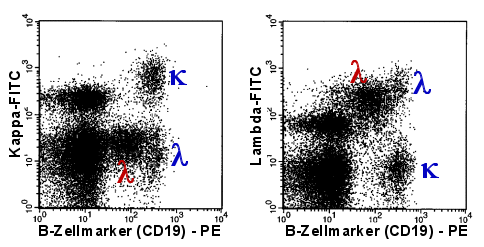 |
Dass lambda-monoklonale B-Zellen vorhanden sind (rotes
griechisches l), erkennt man recht gut, weil diese Zellen
schwächer CD19 sind als die normalen B-Zellen. |
| Bei diesem Patienten ist die monoklonale
B-Zellpopulation eher klein. Sie dominiert nicht wie in dem vorherigen Beispiel und wäre
daher in einem 1-Parameter-Histogramm der Leichtkettenexpression nicht gut zu erkennen. Im
2-Parameter-Dot-Plot wird die Population hingegen durch ihre schwache CD19-Expression von
den gesunden B-Zellen abgetrennt. Ihre Monoklonalität ist dadurch leicht zu erkennen. |
Nicht immer ist es CD19. Auch CD20, CD79, CD38 oder andere
Marker helfen manchmal, die gesunden von den kranken B-Zellen zu unterschieden. Kombiniert
man diese Marker dann mit kappa/lambda, ist die Monoklonalität meist auch bei kleinen
Population gut nachweisbar
|
 |
|
|
|
|
2. Suche nach B-Zellen mit abnormer Antigenexpression Weit weniger wichtig als die Suche nach monoklonalen B-Zellen ist die Suche
nach B-Zellen, die abnorme Antigene auf ihrer Oberfläche zeigen.
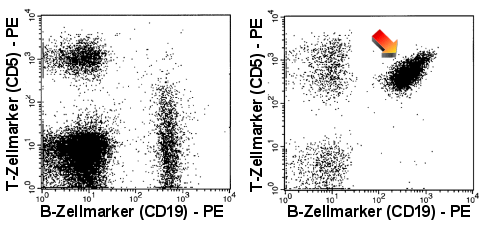 |
Expression von CD5
Die B-Zellen rechts (Pfeil) zeigen eine starke Expression von CD5, wie sie normalerweise
nur auf T-Zellen vorkommt. Zum Vergleich links das normale Bild. |
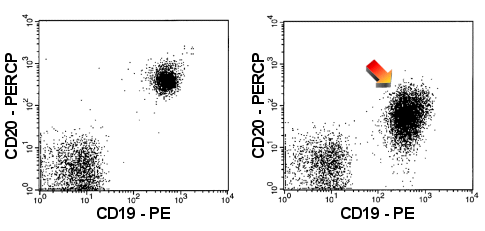 |
Schwache Expression von CD20
Die B-Zellen rechts (Pfeil) zeigen eine schwache Expression von CD20. Zum Vergleich links
das normale Bild. |
| In den rechten Dot-Plots sind die B-Zellen einer
CLL (Chronisch Lymphatischen Leukämie) dargestellt, die typischer Weise eine deutliche
CD5-Expression und eine schwache CD20-Expression zeigen. |
Vorsicht: Eine abnorme Antigenexpression ist
ein eher unsicheres Zeichen für eine maligne B-Zell-Erkrankung. Besonders, wenn nur
wenige B-Zellen die abnorme Antigenexpression zeigen. Kleinere B-Zellpopulationen können
auch beim Gesunden und erst recht bei nicht-malignen Erkrankungen recht eigenartige
Antigenexpressionen zeigen, ohne dass eine maligne Erkrankung dahinter steckt. Im
Zweifelsfall sollte man mit einer Leichtkettenfärbung die Klonalität dieser
B-Zellpopulation abklären.
Bei kleinen Populationen mit abnormer Antigenexpression muss man unbedingt auch an
das Carry-Over denken, also an die Verschleppung von Zellen von einem Röhrchen ins
andere. So manche "unerklärliche" Population hat sich bei näherer Betrachtung
schon als Verschleppung aus dem vorigen Röhrchen entpuppt. Und ein gewisser Grad an
Verschleppung ist kaum vermeidbar. |
 |
|
|
|
|
3. Definieren der Antigenexpression der abnormen
B-Zellen Hat man einmal herausgefunden, dass
eine abnorme, monoklonale B-Zellpopulation vorliegt, dann muss man sie näher
charakterisieren. D.h., man muss die Expression der für eine Diagnose wichtigen Antigene
dieser B-Zellen beschreiben. Dies ist meist eine relativ leichte Aufgabe. Man misst ja
ohnehin meist alle wichtigen Marker in einem Ansatz. Jetzt braucht man sich nur noch die
Ergebnisse anzusehen:
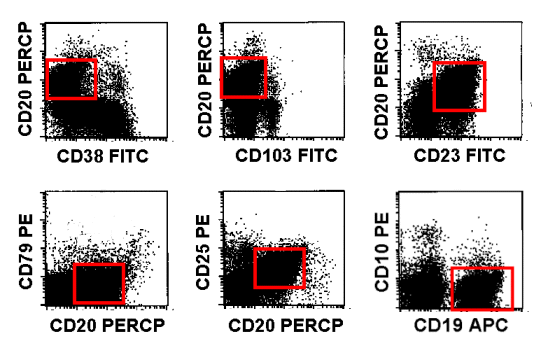 |
Antigenmuster der abnormen B-Zellen
Die monoklonalen B-Zellen zeigten sich CD38neg, CD103neg, CD23pos, CD79neg, CD25pos
und CD10neg.PerCP: Peridinin Chlorophyll
Protein
APC: Allophycocyanin |
|
 |
|
|
|
|
4. Das
Stellen der Diagnose des B-NHL Vorbemerkung
Dies ist ein heikler Punkt. Kann man durchflusszytometrisch überhaupt eine Diagnose
stellen? Nicht immer, ja eigentlich gar nicht so oft. Aber oft wird das Ergebnis der
durchflusszytometrischen Analyse die eine Diagnose sehr wahrscheinlich, die andere wieder
sehr unwahrscheinlich machen. Deswegen ist die Durchflusszytometrie auch in den Fällen,
in denen sie keine definitive Diagnose liefern kann, ein wertvoller Mosaikstein für die
Abklärung.
Vorgehen
Im vorigen Abschnitt haben wir das Antigenmuster der monoklonalen Population beschrieben.
Nun muss man überlegen, zu welcher malignen B-Zellerkrankung das Antigenmuster passt. Zur
Orientierung sind in der nachfolgenden Tabelle die Antigenexpressionen wichtiger reifer,
maligner B-Zellerkrankungen aufgeführt.
| |
CLL/SLL |
IC |
PLL |
MCL |
HCL |
FCL |
surf.IG |
schw. + |
+ |
+ |
+ |
+ |
+ |
CD5 |
+ |
- bis schw. + |
- bis schw. + |
+ |
- |
- |
CD10 |
- |
- |
- |
- |
- |
+ |
CD11c |
- bis mittel + |
-/+ |
-/+ |
- |
stark + |
- |
CD19 |
+ |
+ |
+ |
+ |
+ |
+ |
CD20 |
schw. + |
+ |
+ |
+ |
+ |
+ |
CD22 |
- bis schw. + |
+ |
+/- |
+ |
+ |
+ |
CD23 |
+ |
- |
-/+ |
- |
- |
+/- |
CD24 |
+ |
+/- |
+ |
+ |
+ |
+ |
CD25 |
- bis schw. + |
- bis schw. + |
- |
- |
+ |
- |
CD38 |
- bis schw. + |
+/- |
- |
|
selten + |
|
CD43 |
+ |
+ |
+ |
+ |
- |
- |
CD79b |
- |
+ |
+ |
+ |
+ |
+ |
CD103 |
- |
- |
- |
- |
+ |
- |
FMC7 |
- |
+ |
+ |
+ |
+ |
+ |
CLL: Chronisch lymphatische Leukämie
SLL: Small Lymphocytic Lymphoma
IC: Immunozytom
PLL: Prolymphozytenleukämie;
MCL: Mantelzell-Lymphom;
HCL: Haarzell-Leukämie;
FCL: Follikuläres Lymphom |
Es klingt sehr einfach; Man vergleicht das gemessene Muster
mit den in der Tabelle angegeben und weiß dann, welche Erkrankung vorliegt. Dem ist aber
leider nicht so.
Es gibt verschiedene Probleme:
- Bestimmte Muster sind zwar typisch aber keineswegs obligatorisch
Was heißt das? Beispiel: Eine CLL ist zwar typischer Weise CD23pos, kann aber auch
negativ sein. Und das gilt für fast alle Antigene. Fast keines ist in allen Fällen oder
in keinem Fall vorhanden. Auf praktisch keines kann man sich 100%ig verlassen.
- Die Bedeutung eines Markers hängt von der Expression anderer Marker
ab
Beispiel: Ist CD5 positiv, dann ist CD23 wichtig, weil es dann bei der Unterscheidung der
CLL und des MCL hilft. Ist CD5 negativ, dann ist CD23 relativ unwichtig.
- Bei manchen Antigenen ist nicht nur wichtig, ob sie auf den B-Zellen
zu finden sind (=positiv) oder nicht (=negativ), sondern wie stark sie
auf den B-Zellen sind.
Die Schilderung dieser Probleme soll verdeutlichen, dass die
Befundung einer durchflusszytometrischen Analyse bei malignen Erkrankungen weit
schwieriger ist und weit größerer Erfahrung bedarf als es die simple, tabellarische
Auflistung der Antigenexpressionsmuster vermuten lassen würde.
|
 |
|
|
|
|
IV. Durchflusszytometrische
Untersuchungen bei Verdacht auf Leukämien oder Lymphome reifer T-Zellen oder Natural
Killer-Zellen Dabei handelt es sich um maligne
Proliferationen (Vermehrungen) von reifen T-Lymphozyten, die man alle zu den T-NHL, den
T-Non-Hodgkin-Lymphomen zählt, sowie um Neoplasien der Natural Killer-Zellen (NK-Zellen).
Die Grenze zwischen Lymphomen (Erkrankung vorwiegend im Lymphknoten oder anderen
lymphatischen Organen) und Leukämien (massive Ausschwemmung ins Blut) ist fließend und
willkürlich.
In diese Gruppe fallen z.B. die T-PLL (T-Prolymphozytenleukämie), die T-LGL
(T-Large-Granular-Lymphozyten-Leukämie) und die NK-Zell-Leukämie. Aber auch andere
Leukämien und viele Lymphome zählen zu dieser Gruppe.
Bei der Diagnose dieser Erkrankungen spielt die Durchflusszytometrie
nicht so eine große Rolle wie bei den reifen B-Zell-Neoplasmen, sie kann aber in vielen
Fällen den Verdacht aussprechen und damit die weiteren Untersuchungen in die richtige
Richtung leiten.
Abschnitte:
|
 |
|
|
|
|
Die
Stufen der Diagnose der reifen malignen T- und NK-Zellerkrankungen
 |
Finden der abnormen T- oder
NK-Zellpopulation
(Sind überhaupt pathologische, maligne T- oder NK-Zellen vorhanden?)
- Suche nach T-Zellen mit abnormen
Merkmalen an ihrer Oberfläche (also mit abnormer Antigenexpression). Im
Gegensatz zu den B-Zellen, wo der Nachweis der Monoklonalität im Vordergrund steht, ist
bei T-Zellen der Nachweis der abnormen Antigenexpression am wichtigsten.
- Suche nach monoklonalen
T-Zellen (also nach solchen, die wahrscheinlich nur von einer einzigen Zelle
abstammen, wie das Tumorzellen tun). Leider ist dies heute bei T-Zellen nur sehr schwer in
der Routinediagnostik durchführbar. Man bräuchte dazu eine Menge verschiedener
Antikörper und auch dann wird man die Monoklonalität oft nicht beweisen können.
Bei NK-Zellen ist es derzeit durchflusszytometrisch überhaupt nicht möglich, die
Klonalität zu beweisen.
|
 |
Definieren
der Antigenexpression der pathologischen T- oder NK-Zellpopulation (Welche
Merkmale tragen die pathologischen Zellen an ihrer Oberfläche?)
|
 |
Stellen
der Diagnose
Manchmal sagen einem die durchflusszytometrischen Ergebnisse, welche Erkrankung, welches
T-NHL oder ob ein NK-NHL vorliegt, manchmal kann man die möglichen Erkrankungen zumindest
eingrenzen. |
Anmerkung: diese Stufen bedeuten nicht unbedingt auch mehrere
Untersuchungsschritte. Die Stufen sind eher als gedankliche Schritte aufzufassen, mit
denen man sich der Diagnose nähert.
|
 |
|
|
|
|
1. Suche nach T-Zellen mit abnormer Antigenexpression Zeigt sich ein auf normalen Zellen nicht vorhandenes
Antigenexpressionsmuster, kann dies ein Hinweis auf eine maligne T-Zellerkrankung sein.
Abnorme Antigenexpression kann auch der Verlust eines normalerweise vorhandenen Antigens
sein.
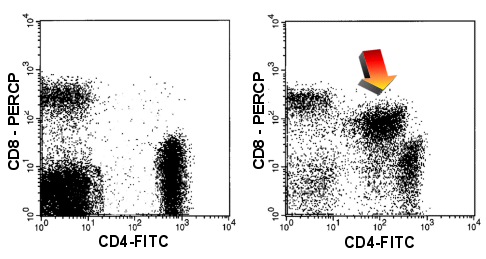 |
CD4/CD8
Doppelexpression
Im rechten Dot-Plot sieht man T-Zellen, die CD4pos und CD8pos sind (Pfeil). Das ist
abnorm. Beide Antigene sind dazu schwächer als auf normalen Zellen. Links ein normales
Bild. |
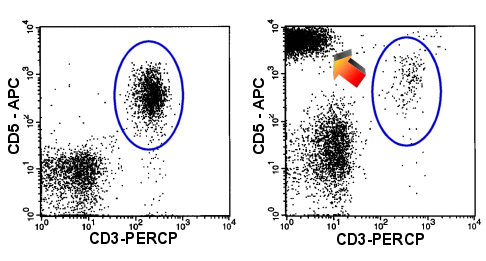 |
CD3-Verlust
CD5 Überexpression
Im rechten Dot-Plot sieht man T-Zellen, denen CD3 fehlt und die zuviel CD5 exprimieren
(Pfeil). Nur mehr wenige normale T-Zellen (blaues Oval). Links ein normales Bild. |
Vorsicht: Wie bei den B-Zellen gilt: Eine
abnorme Antigenexpression ist ein eher unsicheres Zeichen für eine maligne Erkrankung.
Besonders, wenn nur wenige Zellen die abnorme Antigenexpression zeigen. Kleinere
T-Zellpopulationen können auch beim Gesunden und erst recht bei nicht-malignen
Erkrankungen recht eigenartige Antigenexpressionen zeigen, ohne dass eine maligne
Erkrankung dahinter steckt.
Bei kleinen Populationen mit abnormer Antigenexpression muss man unbedingt auch an
das Carry-Over denken, also an die Verschleppung von Zellen von einem Röhrchen ins
andere. So manche "unerklärliche" Population hat sich bei näherer Betrachtung
schon als Verschleppung aus dem vorigen Röhrchen entpuppt. Und ein gewisser Grad an
Verschleppung ist kaum vermeidbar. |
 |
|
|
|
|
2. Suche nach monoklonalen T-Zellen Monoklonale T-Zellen sind leider viel schwerer zu erkennen als monoklonale
B-Zellen. Das liegt daran, dass die T-Zellen keine dem kappa/lambda-Verhältnis
gleichwertige Eigenschaft haben, die uns die Monoklonalität auf einfache Weise erkennen
ließe.
Ein wenig Ähnlichkeit mit der kappa/lambda-Ratio hat die CD4/CD8-Ratio der T-Zellen. Das
ist das Verhältnis von CD4-positiven T-Zellen zu CD8-positiven T-Zellen. Aber nur wenn
diese Ratio sehr hoch oder sehr niedrig ist und dies durch eine Vermehrung einer der
beiden T-Zellpopulationen bedingt ist, kann man den Verdacht auf eine maligne
T-Zellerkrankung aussprechen.
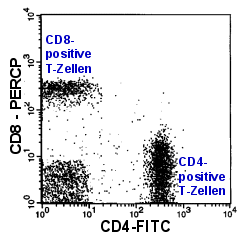 |
CD4/CD8-Ratio
Normalerweise beträgt das Verhältnis von CD4- zu CD8-T-Zellen im Blut etwa 2 zu 1. Eine
T-Zell-Leukämie kann dieses Verhältnis stark verändern. Leider können auch viele
nicht-maligne Erkrankungen die Ratio stark verändern. Daher sind nur starke
Verschiebungen der Ratio, die durch Vermehrung einer Population bedingt sind,
aussagekräftig. |
Im Vergleich zur kappa/lambda-Ratio hat die
CD4/CD8-Ratio viele Nachteile. Die CD4/CD8-Ratio schwankt auch bei nicht-malignen
Erkrankungen sehr stark, sodass man bei der Beurteilung vorsichtig sein muss. In der
Praxis heißt dies, dass man nur extreme Veränderungen der CD4/CD8-Ratio als Hinweis auf
eine maligne T-Zellerkrankung werten darf. Sonst stiftet man sehr viel Verwirrung und
Unruhe durch falsche Verdachtsdiagnosen.
Auch wird eine veränderte CD4/CD8-Ratio häufig durch eine Verminderung einer der beiden
Gruppen verursacht. Und eine Verminderung z.B. der CD8-Zellen kann man kaum als Hinweis
auf ein monoklonale CD4-T-Zellerkrankung sehen, auch wenn die Ratio dadurch auf z.B. 10
steigt.
Ein weiterer Nachteil gegenüber der kappa/lambda-Ratio ist folgender: ist die
kappa/lambda-Ratio nicht eindeutig, gelingt es oft, sich die verdächtige B-Zellpopulation
mit anderen Antikörpern "herauszufischen" und nachzusehen, ob die
kappa/lambda-Ratio auf dieser Population in Ordnung ist. Denn das sollte sie sein, wenn es
sich um nicht-maligne B-Zellen handelt. Bei den T-Zellen ist das anders. Man kann sich
zwar auch mit Antikörpern verschiedene T-Zellpopulationen "herausfischen", aber
viele dieser T-Zellpopulationen haben schon normalerweise eine einseitige CD4/CD8-Ratio,
ohne dass sie eine maligne T-Zellpopulation darstellen würden. Man kann eine verschobene
CD4/CD8-Ratio dann nicht als Hinweis auf eine maligne T-Zellerkrankung werten.
|
 |
|
|
|
|
3. Definieren
der Antigenexpression der abnormen T-/NK-Zellen Hat man erst einmal erkannt, dass eine maligne Population vorhanden ist, wird
man, so wie bei den B-Zellen beschrieben,
das Antigenmuster der Population aus den durchflusszytometrischen Ergebnissen ablesen und
zusammenfassen.
|
 |
|
|
|
|
4. Das
Stellen der Diagnose des T-/NK-NHL Vorbemerkung
In vielen Fällen wird man durchflusszytometrisch keine Diagnose stellen können. Aber oft
wird das Ergebnis der durchflusszytometrischen Analyse die eine Diagnose sehr
wahrscheinlich, die andere wieder sehr unwahrscheinlich machen. Deswegen ist die
Durchflusszytometrie auch in den Fällen, in denen sie keine definitive Diagnose liefern
kann, ein wertvoller Mosaikstein für die Abklärung.
Vorgehen
Im vorigen Abschnitt haben wir das Antigenmuster der monoklonalen Population beschrieben.
Nun muss man überlegen, zu welcher malignen T- oder NK-Zellerkrankung das Antigenmuster
passen könnte. Zur Orientierung sind in der nachfolgenden Tabelle die Antigenexpressionen
wichtiger reifer, maligner T- und NK-Zellerkrankungen aufgeführt.
| |
T-PLL |
T-LGL |
NK-LGL |
Sezary-
Syndrom |
CD2 |
+ |
+ |
+ |
+ |
CD3 |
+ |
+ |
- |
+ |
CD4 |
+/- |
- |
- |
+ |
CD5 |
+ |
+/- |
- |
+ |
CD7 |
+ |
+/- |
+/- |
- |
CD8 |
-/+ |
+ |
+/- |
- |
CD16 |
- |
-/+ |
+/- |
- |
CD25 |
+/- |
- |
- |
- |
CD56 |
- |
- |
+/- |
- |
CD57 |
- |
+/- |
-/+ |
- |
HLA-DR |
-/+ |
- |
- |
- |
CD4+CD8+
Koexpression |
25%
der
Fälle |
|
|
|
T-PLL:
T-Prolymphozytenleukämie
T-LGL: Large Granular Lymphocyte Leukemia (LGL), T-Zelltyp
NK-LGL: LGL Leukemia, NK-Zelltyp |
Es klingt sehr einfach; Man vergleicht das gemessene Muster
mit den in der Tabelle angegeben und weiß dann, welche Erkrankung vorliegt. Dem ist aber
leider nicht so.
Es gelten aber die gleichen Einschränkungen wie bei B-NHL:
- Bestimmte Muster sind zwar typisch aber keineswegs obligatorisch
Was heißt das? Beispiel: Eine Sezary-Syndrom ist zwar typischer Weise CD7negativ, kann
aber auch positiv sein. Und das gilt für fast alle Antigene. Fast keines ist in allen
Fällen oder in keinem Fall vorhanden. Auf praktisch keines kann man sich 100%ig
verlassen.
- Die Bedeutung eines Markers hängt von der Expression anderer Marker
ab
- Bei manchen Antigenen ist nicht nur wichtig, ob sie auf den B-Zellen
zu finden sind (=positiv) oder nicht (=negativ), sondern wie stark sie auf den B-Zellen
sind.
Die Schilderung dieser Probleme soll verdeutlichen, dass die
Befundung einer durchflusszytometrischen Analyse bei malignen Erkrankungen weit
schwieriger ist und weit größerer Erfahrung bedarf als es die simple tabellarische
Auflistung der Antigenexpressionsmuster vermuten lassen würde.
|
 |
|
|
|
|
V. Durchflusszytometrische
Untersuchungen bei Akuten Leukämien Was
sind akute Leukämien?
Akute Leukämien (akuter Blutkrebs) sind Erkrankungen mit unkontrolliertem Wachstum
unreifer Blutzellen. Die Eigenschaft "akut" kommt daher, dass diese Erkrankungen
im Gegensatz zu den chronischen Leukämien ohne Behandlung in kurzer Zeit zum Tod
führen können.
Wie erfolgt die Einteilung?
Die wichtigste Einteilung der akuten Leukämien erfolgt in die akuten myeloischen
Leukämien (AML), die von unreifen myeloischen Zellen verursacht werden, und die akuten
lymphatischen Leukämien (ALL), die von unreifen lymphatischen Zellen verursacht werden.
Bei beiden Formen kennt man verschiedene Untergruppen.
Bedeutung der Durchflusszytometrie
Die Durchflusszytometrie kann bei der Erkennung einer akuten Leukämie helfen. Von
größerer Bedeutung ist aber meist, dass durch die durchflusszytometrische Untersuchung
rasch und sicher zwischen AML und ALL unterschieden werden kann. Auch für die genaue
Definition der Untergruppen ist die Durchflusszytometrie wichtig, besonders bei der ALL,
in manchen Fällen auch bei der AML.
"Blasten"
Die unreifen Zellen bei akuter Leukämie nennt man auch Blasten. Dabei muss man sich aber
bewusst sein, dass wir immer eine kleine Menge unreifer Zellen (normale Blasten) im
Knochenmark haben.
Abschnitte:
|
 |
|
|
|
|
Die
Stufen der durchflusszytometrischen Untersuchung bei akuter Leukämie
Anmerkung: diese Stufen bedeuten nicht unbedingt auch mehrere
Untersuchungsschritte. Die Stufen sind eher als gedankliche Schritte aufzufassen, mit
denen man sich der Diagnose nähert. |
 |
|
|
|
|
1. Auffinden
der Blastenpopulation Im wesentlichen kann eine
Blastenpopulation durch 2 Dinge auffällig werden
- Auffällige Vermehrung der unreifen Zellen
- Abnorme Markerexpression der unreifen Zellen
a. Auffällige Vermehrung der unreifen Zellen
Es gibt verschiedene Möglichkeiten, unreife Zellen durchflusszytometrisch
nachzuweisen. Eine Möglichkeit ist die Markierung mit Markern, die nur auf unreifen
Zellen vorhanden sind, wie z.B. CD34. Leider ist dieses Antigen auf vielen akuten
Leukämien nicht ausgeprägt. Sicherer ist daher die Darstellung der CD45-Expression gegen
das Seitwärtsstreulicht (Side Scatter). Unreife Zellen sind meistens CD45 etwas
schwächer und haben gleichzeitig einen niedrigen Side Scatter. Mit dieser Methode kann
man auch Blasten erkennen, die CD34-negativ sind. In der Praxis greift man meist auf beide
Methoden zurück.
Nachweis
der Vermehrung unreifer Zellen |
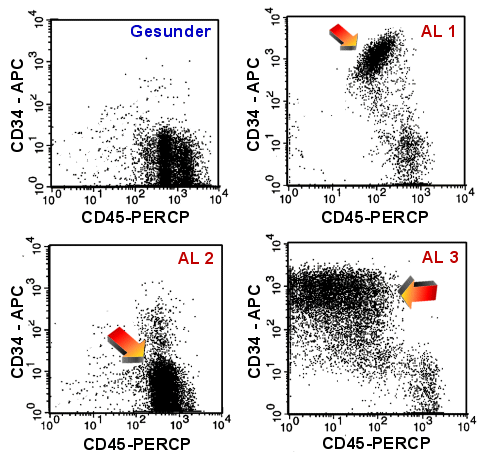 |
Suche unreifer Zellen mit CD45-CD34
Ein Gesunder (links oben) und drei Fälle von akuter Leukämie. Die Pfeile markieren die
Blastenpopulationen, die bei AL 1 und AL 3 gut erkennbar sind.
Bei AL 2 hingegen sieht man kaum einen Unterschied zum Gesunden. Blasten sind
häufig, aber eben nicht immer CD34pos. |
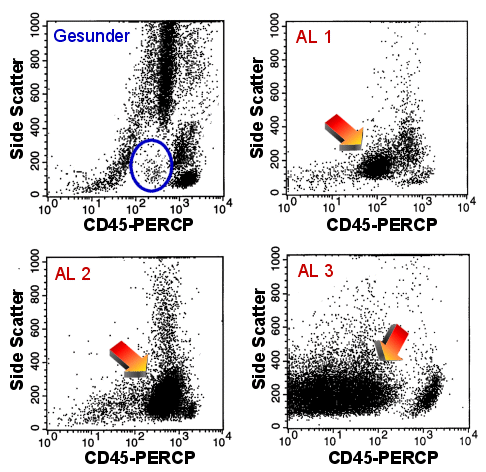 |
Suche unreifer Zellen mit CD45-Side
Scatter
Ein Gesunder (links oben), der im blauen Oval nur wenige Zellen zeigt.
Drei Fälle von akuter Leukämie. Die Pfeile markieren die Blastenpopulationen, die
bei allen Fällen gut erkennbar sind.
In der Darstellung CD45-Side Scatter erkennt man auch die CD34neg Blasten des
Falles AL 2. |
Normalerweise findet man nur sehr geringe Mengen unreifer
Zellen im Blut (bis etwa 0.1 % der Leukozyten) und auch in der Knochenmarksprobe
liegt der Anteil unreifer Zellen meist nicht über 1 bis 2 %. Findet man höhere
Werte, kann dies Ausdruck einer krankhaften Veränderung sein. Von einer akuten Leukämie
spricht man erst ab einem mikroskopisch ermittelten Blastenanteil von 20 %.
Dazu sollte man ergänzen, dass man durchflusszytometrisch oft viel niedrigere
Blastenanteile im Knochenmark bestimmt als mikroskopisch. Das liegt vor allem daran, dass
das Knochenmark bei der Gewinnung stark mit Blut durchmischt wird, und die Blasten dadurch
verdünnt werden. Das bedeutet: Hat man z.B. durchflusszytometrisch 5 % Blastenanteil
bestimmt, mag der wahre Anteil durchaus bei 25 % liegen.
b. Abnorme Markerexpression der unreifen Zellen
Es gibt verschiedene Arten abnormer Markerexpression.
Die wichtigsten sind:
- Expression linienfremder Antigene
Findet man auf myeloischen Zellen lymphatische Marker wie CD19, CD7 oder Marker wie
CD56, ist das abnorm.
Findet man umgekehrt auf lymphatischen Blasten myeloische Marker wie CD13 oder CD33, ist
dies ebenfalls abnorm.
- Asynchrone Antigenexpression
Findet man Marker reiferer Zellen wie CD15 auf unreifen CD34pos Blasten, ist dies
abnorm.
- Abnorme Expressionsstärke
Bei manchen Formen von akuter myeloischer Leukämie ist CD34 wesentlich stärker
exprimiert als auf normalen Blasten. T-ALL zeigen oft eine verminderte oder fehlende
Expression von CD3, B-ALL eine verminderte oder fehlende Expression von CD20.
CD45 wird von den meisten akuten Leukämien schwach bei manchen sogar sehr schwach
exprimiert.
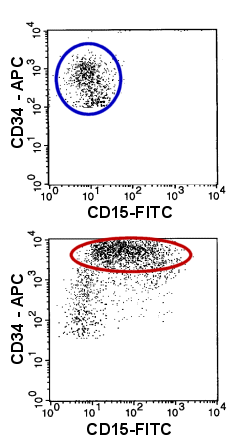 |
Beispiel abnormer Antigenexpression auf myeloischen
Blasten
Im Vergleich zu den normalen Blasten (oberer Dot-Plot, blaues Oval) zeigen die Blasten der
akuten myeloischen Leukämie (unterer Dot-Plot, rotes Oval) eine abnorme Expression von
CD15 und eine abnorm starke Expression von CD34.
Anmerkung: CD34-negative Zellen wurden der Übersichtlichkeit wegen
herausgenommen. |
|
 |
|
|
|
|
2. Definieren
der Antigenexpression Hat man erst einmal
erkannt, dass eine maligne Population vorhanden ist, wird man, so wie bei den B-Zellen beschrieben, das
Antigenmuster der Population aus den durchflusszytometrischen Ergebnissen ablesen und
zusammenfassen.
|
 |
|
|
|
|
3. Stellen
der Diagnose a. Akute Leukämie ja/nein
In dieser Fragestellung muss man das Ergebnis der durchflusszytometrischen Analyse
vorsichtig beurteilen. Findet man mehr als 20 % Blasten, dann ist die Definition
einer akuten Leukämie erfüllt. Findet man aber mit der Durchflusszytometrie weniger
Blasten, kann schon eine akute Leukämie vorliegen, da man den Blastengehalt im
Knochenmark durchflusszytometrisch meist deutlich unterschätzt (wie weiter oben bereits
beschrieben).
b. AML oder ALL
Diese wichtige Frage kann die Durchflusszytometrie meist rasch und sicher klären.
Bestimmte Marker sind typisch für eine AML andere für eine ALL. Welche das sind und wie
verlässlich sie sind, lässt sich ganz gut aus einer Tabelle einer europäischen Gruppe
zur Leukämietypisierung (EGIL) ablesen:
EGIL-Score
für biphänotypische Leukämien |
Punktewert |
B-lymphatisch |
T-lymphatisch |
Myeloisch |
2 |
CD79
(cyt/membran)
CD22
(cyt/membran)
cyt.IgM |
CD3
(cyt/membran)
TCR-a/b
TCR-g/d |
Myelo-
peroxidase
(cytopl.) |
1 |
CD19
CD10
CD20 |
CD2
CD5
CD8
CD10 |
CD13
CD33
CDw65 |
0.5 |
TdT
CD24 |
|
CD14
CD15
CD64
CD117* |
Je höher der Punktewert eines Markers, um so verlässlicher
weist er auf eine bestimmte Linie der akuten Leukämie hin. So ist z.B. der
Myeloperoxidase-Nachweis der sicherste Hinweis auf eine akute myeloische Leukämie (AML)
und der CD79 Nachweis der verlässlichste Hinweis auf eine B-ALL (=B-lymphatische ALL).
*Anzumerken ist, dass sich inzwischen gezeigt hat, dass CD117 viel wertvoller zur
Erkennung einer AML ist als die 0.5 Punkte andeuten. Der Marker sollte mindestens mit
einem Punkt bewertet werden.
c. Welche Untergruppe
Die AML und die ALL werden in verschiedene Untergruppen eingeteilt. Die größte Bedeutung
hat die Durchflusszytometrie für die Einteilung in Untergruppen bei der B-ALL (und zwar
in Pro-B, common-B, prä-B und B-ALL).
Etwas geringer ist die durchflusszytometrische Bedeutung für die Einteilung der T-ALL.
Bei der AML kann die Durchflusszytometrie bei der Erkennung mancher Formen helfen. So kann
die mit anderen Mitteln nur schwierig nachzuweisende M7 (Megakaryoblastenleukämie) durch
den durchflusszytometrischen Nachweis bestimmter Antigene auf den Blasten diagnostiziert
werden.
Auch auf andere Untergruppen kann die Durchflusszytometrie Hinweise liefern. Aber nicht
mehr. Beweisen kann sie eine Untergruppe praktisch nie, weil die Gruppen nicht nach ihren
Antigenmuster definiert sind. Sondern mikroskopisch (nach ihren Charakteristika im
Mikroskop), zytochemisch (nach ihrer Anfärbbarkeit bei Spezialfärbungen) und
zytogenetisch (nach ihren Auffälligkeiten im Chromosomensatz).
|
 |




